
domingo, agosto 29, 2010
Antimicrobial activity of four plants from Peruvian north-east

miércoles, marzo 04, 2009
ESSENTIAL OIL ACTIVITY OF Minthostachys mollis "MUÑA"

Demonstrate the antifungal activity in vitro and elucidation of some metabolites of the essential oil of Minthostachys mollis (muña) leaves from the Huacrapuquio district (2700 m), Junín (Central Peruvian Andes). Material and methods. The essential oil was obtained by the distillation method by drag of water vapor. This was performed to physical-chemical analysis and identification of the chemical composition by gas chromatography. By agar diffusion method was evaluated inhibition of fungal growth of Candida albicans and by tube dilution method to Trichophyton tonsurans, Trichophyton mentagrophytes and Microsporun canis. Results. The following monoterpenes were found: pulegone, menthone, limoneno and myrcene. The muña essential oil completely inhibited T. tonsurasn, T. mentagrophytes and M. canis with both evaluation methods and doses, to C. albicans was a inhibition zone diameters of 30 mm for the essential oil to 100 % and 35 mm to 50%. Conclusions. We showed the antifungal activity of muña essential oil, probably by the action of the monoterpenes found.
Hipertermofilos presentación power point
BIOFILM O BIOPELICULA

Las biopelículas, cambiaran el panorama de la microbiología dentro de poco tiempo.
Aquí les presento unas dispositivas al respecto
http://www.badongo.com/es/file/13585708
jueves, marzo 27, 2008
CONTROL DE CALIDAD MICROBIOLÓGICO DE PRODUCTOS COSMÉTICOS
Hoy en día el farmacéutico es el profesional responsable de la producción de cosméticos de calidad, seguros y eficaces y para lograr este objetivo el control microbiológico se considera de gran importancia, ya que en estos productos se pueden presentar las condiciones necesarias para la multiplicación de microorganismos capaces de deteriorar al producto o, lo que es peor, afectar la salud del consumidor.
DEFINICIÓN: los Cosméticos, Productos de Higiene y Perfumes “son preparaciones constituidas por substancias naturales o sintéticas, de uso externo en las diversas partes del cuerpo humano, piel, sistema capilar, uñas, labios, órganos genitales externos, dientes y membranas mucosas de la cavidad oral, con el objetivo exclusivo o principal de limpiarlos, perfumarlos, alterar su apariencia y/o corregir olores corporales y/o protegerlos o mantenerlos en buen estado”
CONSIDERACIONES GENERALES PARA LA MANIPULACIÓN DE LAS MUESTRAS ANTES DE REALIZAR EL ANÁLISIS MICROBIOLÓGICO
El Manual de Bacteriología Analítica (Bacteriological Analytical Manual (BAM)) indica una serie de recomendaciones para la manipulación de las muestras de productos cosméticos que van a ser sometidos a un análisis microbiológico. Estas recomendaciones son las siguientes:
· Una vez que se recibe una muestra de un producto cosmético, ésta se debe analizar lo más pronto posible, sin embargo, cuando es necesario almacenarla se debe hacer en un lugar limpio que se encuentre a temperatura ambiente. Las muestras nunca se deben incubar, refrigerar o congelar antes o después de su análisis microbiológico.
· Es importante inspeccionar cuidadosamente el aspecto que presenta la muestra en el momento que se recibe y se debe anotar cualquier irregularidad que se observe en el envase.
· Antes de abrir el envase y tomar la muestra del producto para realizar el análisis microbiológico, se debe desinfectar su superficie con cualquiera de las siguientes soluciones desinfectantes:
· Etanol al 70% (v/v) y HCl al 1% en agua
· Iodo al 4% en etanol 70%
· Glutaraldehido al 2%
Si es necesario después de desinfectarlas se debe secar el envase con una gasa estéril.
· Para hacer el análisis microbiológico es importante utilizar una porción representativa del contenido de la muestra. Cuando se trata de productos que contienen menos de 1 g o menos de 1 mL, se debe analizar el contenido completo del envase.
· Cuando se dispone de una sola muestra a la que se deben realizar otros ensayos (químico, toxicológico, etc.), se debe tomar primero la parte de muestra que va a ser utilizada en el análisis microbiológico. En este caso la cantidad de muestra a tomar, dependerá del contenido total del producto. Por ejemplo, si la muestra contiene sólo 5 mL, se pueden usar 1 o 2 mL para realizar este análisis.
· Preferiblemente el análisis microbiológico se realiza bajo campana de flujo laminar, sin embargo, si no es posible, se puede acondicionar una cabina para realizar este ensayo.
· Todas las manipulaciones de la muestra se deben realizar asépticamente.
Cuando se preparan muestras cosméticas para la realización de un análisis microbiológico, es importante garantizar que los microorganismos, que pudiesen estar como contaminantes, van a ser detectados y que el analista, durante la realización del ensayo, no aporta ningún tipo de contaminante. Para ello es importe:
Incorporar completamente la muestra en el medio de cultivo.
Emplear técnicas asépticas.
CONTENIDO MICROBIANO EN MATERIA PRIMA
La industria cosmética tiene que usar agua y sistemas de agua validados y controlados.
Hay que tener en cuenta las siguientes consideraciones generales:
Composición química
Naturaleza física
Origen y disponibilidad
Uniformidad de lote
Uso destinado del producto
Concentración de la materia usada en el producto
Procesos de manufactura
Historia de la materia prima
Condiciones de almacenamiento
Actividad del agua
Criterios específicos
Se recomienda como mínimo usar 1 g o 1 mL de muestra.
Todos las materias primas sintéticas o naturales <>
LIMITES MICROBIOLÓGICOS PARA PRODUCTOS COSMÉTICOS
Hay que tener en cuenta criterios como uso del producto, ruta de administración y población objetivo cuando se establecen guías microbiológicas para seguridad y eficacia.
Dado que los “productos cosméticos” no son productos estériles, pueden sufrir contaminación microbiana por el ambiente, materia prima, componentes, etc.
Las formulaciones que pueden soportar m.o. o son susceptibles de contaminación microbiana deben contener conservadores para retardar el crecimiento microbiano.
Se recomienda que los equipos utilizados en los procesos de fabricación de los cosméticos deben estar diseñados para una fácil limpieza y sanitización; así como aplicar las buenas prácticas de manufactura para evitar accidentes humanos o contaminación microbiana ambiental durante la manufactura.
Es responsabilidad de los fabricantes asegurarse que:
Ningún m.o. presente es capaz de crecer en el producto
Las especies y cantidad de microbios no representen un peligro al consumidor cuando se usa el producto tal cual se indica.
Ningún m.o. presente debe comprometer la estabilidad del producto.
El producto, empacado y la integridad del cerrado deben ser seguros.
Criterios específicos
Se usa el método de conteo en placa, y como paso previo es necesario inactivar los inhibidores de crecimiento de m.o. si están presentes.
A continuación presentamos los diferentes límites utilizados por los principales organizaciones que regulan la industria cosmética a nivel mundial.
Limites Microbianos CTFA (The Cosmetics, Toiletry, and Fragance Association)
Productos para bebe menos de 100 ufc/g o mL
Productos para el áres de los ojos menos de 100 ufc/g o mL
Resto de productos menos de 1000 ufc/g o mL
Ausencia de Staphylococcus aureus, Escherichia coli, y Pseudomonas aeruginosa.
Limites microbianos European comission
Defienen dos categorías de cosméticos
Categoría 1: Productos dirigidos a niños menores de 3 años, área de los ojos y membranas mucosas.
Categoría 1: Total de m.o. aeróbico mesófilos viables menos de 100 ufc/g o mL en 0.5 g o mL de producto.
Categoría 2: Total de m.o. aeróbico mesófilos viables menos de 1000 ufc/g o mL en 0.1 g o mL de producto.
domingo, noviembre 26, 2006
PERUVIAN MEDICINAL PLANTS WITH ANTIFUNGAL ACTIVITY
The present work investigated the antifungal activities in vitro of twelve ethanolic extracts corresponding to ten peruvian medicinal plants; Annona cherimolia Mill. (leaves), Annona muricata L. (bark and leaves), Bidens pilosa L. (aerial parts), Hypericum laricifolium L. (aerial parts), Juglans neotropica Diels (bark), Piper spp. (leaves), Plantago major L. (leaves), Psidium guajava L. (leaves), Schinus molle L. (bark and leaves) and Spartium junceum L. (whole plant). The plants were collected in the department of Amazonas, except Schinus molle L (Apurímac) and Annona muricata L. (Lima). The antifungal activities were determinated by the methods of agar diffusion and agar dilution for the determination of the Minimal Inhibitory Concentration (MIC). The used microorganisms of test were the yeasts Candida albicans ATCC 10231 and Candida albicans clinical isolate, as well as, the filamentous fungus Aspergillus niger ATCC 16404; the microorganism were provided by the Chair of Microbiology of Faculty of Pharmacy and Biochemistry of the Universidad Nacional Mayor de San Marcos. Of twelve investigated extracts, six presented significant antifungal activity with a diameter of inhibition haloes >18mm (Agar Diffusion) against Candida albicans ATCC 10231. No extract showed significant activity against to Candida albicans clinical isolate and Aspergillus niger ATCC 16404. The MIC of the extracts that presented significant activity against Candida albicans ATCC 10231, were of 250 ug/mL for Hypericum laricifolium L., Juglans neotropica Diels, Psidium guajava L. and Schinus molle (bark and leaf extracts) and of 500 ug/mL for Piper spp. We do not determine the MIC of the extracts (Juglans neotropica Diels and Psidium guajava L.) that presented haloes against Aspergillus niger ATCC 16404 for considering them without significant activity <18mm>
lunes, noviembre 20, 2006
MICROORGANISMOS HIPERTERMOFILOS
ES CONOCIDO QUE LOS MICROORGANISMOS OCUPAN TODOS LOS NICHOS ECOLÓGICOS EN NUESTRO PLANETA. CON RESPECTO A LA TEMPERATURA TENEMOS LOS PSICRÓFILOS, MESÓFILOS, TERMÓFILOS Y LOS HIPERTERMÓFILOS.

Pakchung A. et al Envirom Chem. 2006 3, 77-93
COMO PODEMOS OBSERVAR EN EL CUADRO SE CONSIGNAN LOS DIFERENTES EXTREMOFILOS. EN CUANTO A HIPERTERMOFILOS (M.O. QUE VIVEN ENTRE 80 ºC - 113 ºC), SOLO SE CONOCEN REPRESENTANTES DE LOS DOMINIOS ARCHAEA Y BACTERIA Y NINGUN EUCARIOTA.
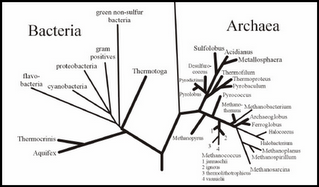
EN LA FIGURA OBSERVAMOS RESALTADOS EN NEGRITA A LAS PRINCIPALES FAMILIAS DE BACTERIAS Y ARQUEAS HIPERTERMOFILAS.
LA BACTERIA HIPERTERMOFILA MAS RESISTENTE CONOCIDA ES
Aquifex pyrophilus crece hasta a 95ºC
LA ARQUEA HIPERTERMOFILA MAS RESISTENTE CONOCIDA Y PUBLICADA ES
Pyrolobus fumarii crece hasta 113 ºC
•Max. 113ºC
•Temperatura óptima crec. 106 ºC
•Aislado de paredes de fuentes termales submarinas (Oceano altántico)
•Incapaz de crecer a menos de 90 ºC
•Cel. 0.7 – 2.5 um diámetro
•Es quimiolitoautotrófico
•Reduce nitrato, formando amonio como prod. Final
•Puede crecer en cond. Microaerófilas con Hidrógeno como donador de electrones y trazas de O2 (0.05%)
¿DONDE VIVEN ESTOS M.O.?
LOS ENCONTRAMOS EN AMBIENTES TERRESTRES Y MARINOS
EN FUENTES HIDROTERMALES SUBMARINAS Y EN LOS GEISERES, CAMPOS SOLFATIRICOS E INCLUSO EN EL SUBSUELO EN AMBIENTES TERRESTRES
¿CÓMO HACEN ESTOS MICROORGANISMOS PARA VIVIR A TALES TEMPERATURAS?
PRIMERO QUE NADA ADAPTAN TANTO SU MAQUINARIA ENZIMÁTICA Y ESTRUCTURAL PARA PODER RESISTIR ESTAS TEMPERATURA.
EN CUANTO A SU METABOLISMO LA MAYORIA SON QUIMIOLITOTROFOS, LA MAYORIA ANAEROBICOS PERO TAMBIEN LOS HAY HETEROTROFOS Y AEROBICOS.
ESTOS M.O. HAN MODIFICADO SU MEMBRANA CELULAR, LOS LIPIDOS QUE LO CONFORMAN TIENEN MODIFICACIONES LA MAYORIA TIENEN ENLACES ETER, ANILLOS CICLOPENTANO, UNIONES COVELENTES INTERNAS, ETC.
EN CUANTO A SUS PROTEINAS SUFREN LAS SIGUIENTES MODIFICACIONES
Aumento
• Variedad de puentes salinos
• Redes de puentes de hidrógeno
• Extensión de empaquetamiento de residuos no polares
• Propensidad para formar oligomeros
• Expresión de HSPs chaperonas
Disminución
• Volumen
• Longitud de lazos superficiales
EL ADN Y EL ARN TAMBIÉN SE MODIFICAN. EL ADN SE ESTABILIZA CON LA PRESENCIA DE ALTAS CONCENTRACIONES DE SAL, POLIAMINAS Y PROTEINAS CATIÓNICAS, ADEMAS POSEEN UNA ADN GIRASA REVERSA CARACTERÍSTICA QUE LES DA UN SUPERENRROLLAMIENTO POSITIVO. EN EL ARN HAY MODIFICACIONES POST-TRANSCRIPCIONALES QUE RESTRINGEN LA FLEXIBILIDAD DEL ARN.
LOS POLINUCLEOTIDOS TAMBIÉN SUFREN MODIFICACIONES
Modificaciones post-trnascripcionales
de ARNt
• 2’-metilación grupo ribosa
• N-acetilación de citidina
• Polimetilación de guanosina
BIBLIOGRAFIA RECOMENDADA
Pakchung A. et al Envirom Chem. 2006 3, 77-93
Rothschild, L. Nature 2001 409:1092-1101
KARL O. STETTER
http://www.dlr.de/me/Institut/Abteilungen/Strahlenbiologie/pdf/astrobiologie/P2_11.pdf
Charlier D. & Droogmans L Cell Moll Life Sci 62(2005) 2974-2884.
Daniel R. & Cowan D. Cell Mol. Life Sci 57 (2000) 250-264
martes, octubre 31, 2006
PLANTAS MEDICINALES PERUANAS ACTIVIDAD ANTIFUNGICA

Julio Ruiz Q*., María Huamani A., Mirtha Roque A.
Instituto de Investigación en Química Biológica, Microbiología y Biotecnología “Marco Antonio Garrido Malo”
El presente trabajo investiga la actividad antifúngica in vitro de doce extractos etanólicos que corresponden a diez plantas medicinales peruanas; Annona cherimolia Mill. (hojas), Annona muricata L. (corteza y hojas), Bidens pilosa L. (partes aéreas), Hypericum laricifolium L. (partes aéreas), Juglans neotropica Diels (corteza), Piper spp. (hojas), Plantago major L. (hojas), Psidium guajava L. (hojas), Schinus molle L. (corteza y hojas) y Spartium junceum L. (planta entera). Las especies fueron recolectadas en el departamento de Amazonas, excepto Schinus molle L. (Apurímac) y Annona muricata L. (Lima). La actividad antifúngica se evaluó mediante los métodos de difusión en agar y dilución en agar para la determinación de la concentración mínima inhibitoria (CMI). Los microorganismos de prueba utilizados fueron las levaduras Candida albicans ATCC 10231 y Candida albicans cepa clínica, así como, el hongo filamentoso Aspergillus niger ATCC 16404; las cepas fueron proporcionadas por la Cátedra de Microbiología de la Facultad de Farmacia y Bioquímica de la Universidad Nacional Mayor de San Marcos. De doce extractos investigados, seis presentaron actividad antifúngica consistente con un diámetro de halos de inhibición ≥18mm (prueba de difusión en agar) frente a Candida albicans ATCC 10231. Ningún extracto mostró actividad consistente frente a la cepa clínica de Candida albicans y Aspergillus niger ATCC 16404. La CMI de los extractos que presentaron actividad consistente frente a Candida albicans ATCC 10231, fue de 250 µg/mL para Hypericum laricifolium L., Juglans neotropica Diels, Psidium guajava L. y Schinus molle L. (un extracto de corteza y uno de hojas) y de 500µg/mL para Piper spp. No se determinó la CMI de los extractos (Juglans neotropica Diels y Psidium guajava L.) que presentaron halos frente al Aspergillus niger ATCC 16404 por considerarlos sin actividad significante (<18mm.). href="mailto:jruizq@unmsm.edu.pe">jruizq@unmsm.edu.pe


