The present work investigated the antifungal activities in vitro of twelve ethanolic extracts corresponding to ten peruvian medicinal plants; Annona cherimolia Mill. (leaves), Annona muricata L. (bark and leaves), Bidens pilosa L. (aerial parts), Hypericum laricifolium L. (aerial parts), Juglans neotropica Diels (bark), Piper spp. (leaves), Plantago major L. (leaves), Psidium guajava L. (leaves), Schinus molle L. (bark and leaves) and Spartium junceum L. (whole plant). The plants were collected in the department of Amazonas, except Schinus molle L (Apurímac) and Annona muricata L. (Lima). The antifungal activities were determinated by the methods of agar diffusion and agar dilution for the determination of the Minimal Inhibitory Concentration (MIC). The used microorganisms of test were the yeasts Candida albicans ATCC 10231 and Candida albicans clinical isolate, as well as, the filamentous fungus Aspergillus niger ATCC 16404; the microorganism were provided by the Chair of Microbiology of Faculty of Pharmacy and Biochemistry of the Universidad Nacional Mayor de San Marcos. Of twelve investigated extracts, six presented significant antifungal activity with a diameter of inhibition haloes >18mm (Agar Diffusion) against Candida albicans ATCC 10231. No extract showed significant activity against to Candida albicans clinical isolate and Aspergillus niger ATCC 16404. The MIC of the extracts that presented significant activity against Candida albicans ATCC 10231, were of 250 ug/mL for Hypericum laricifolium L., Juglans neotropica Diels, Psidium guajava L. and Schinus molle (bark and leaf extracts) and of 500 ug/mL for Piper spp. We do not determine the MIC of the extracts (Juglans neotropica Diels and Psidium guajava L.) that presented haloes against Aspergillus niger ATCC 16404 for considering them without significant activity <18mm>
domingo, noviembre 26, 2006
PERUVIAN MEDICINAL PLANTS WITH ANTIFUNGAL ACTIVITY
The present work investigated the antifungal activities in vitro of twelve ethanolic extracts corresponding to ten peruvian medicinal plants; Annona cherimolia Mill. (leaves), Annona muricata L. (bark and leaves), Bidens pilosa L. (aerial parts), Hypericum laricifolium L. (aerial parts), Juglans neotropica Diels (bark), Piper spp. (leaves), Plantago major L. (leaves), Psidium guajava L. (leaves), Schinus molle L. (bark and leaves) and Spartium junceum L. (whole plant). The plants were collected in the department of Amazonas, except Schinus molle L (Apurímac) and Annona muricata L. (Lima). The antifungal activities were determinated by the methods of agar diffusion and agar dilution for the determination of the Minimal Inhibitory Concentration (MIC). The used microorganisms of test were the yeasts Candida albicans ATCC 10231 and Candida albicans clinical isolate, as well as, the filamentous fungus Aspergillus niger ATCC 16404; the microorganism were provided by the Chair of Microbiology of Faculty of Pharmacy and Biochemistry of the Universidad Nacional Mayor de San Marcos. Of twelve investigated extracts, six presented significant antifungal activity with a diameter of inhibition haloes >18mm (Agar Diffusion) against Candida albicans ATCC 10231. No extract showed significant activity against to Candida albicans clinical isolate and Aspergillus niger ATCC 16404. The MIC of the extracts that presented significant activity against Candida albicans ATCC 10231, were of 250 ug/mL for Hypericum laricifolium L., Juglans neotropica Diels, Psidium guajava L. and Schinus molle (bark and leaf extracts) and of 500 ug/mL for Piper spp. We do not determine the MIC of the extracts (Juglans neotropica Diels and Psidium guajava L.) that presented haloes against Aspergillus niger ATCC 16404 for considering them without significant activity <18mm>
lunes, noviembre 20, 2006
MICROORGANISMOS HIPERTERMOFILOS
ES CONOCIDO QUE LOS MICROORGANISMOS OCUPAN TODOS LOS NICHOS ECOLÓGICOS EN NUESTRO PLANETA. CON RESPECTO A LA TEMPERATURA TENEMOS LOS PSICRÓFILOS, MESÓFILOS, TERMÓFILOS Y LOS HIPERTERMÓFILOS.

Pakchung A. et al Envirom Chem. 2006 3, 77-93
COMO PODEMOS OBSERVAR EN EL CUADRO SE CONSIGNAN LOS DIFERENTES EXTREMOFILOS. EN CUANTO A HIPERTERMOFILOS (M.O. QUE VIVEN ENTRE 80 ºC - 113 ºC), SOLO SE CONOCEN REPRESENTANTES DE LOS DOMINIOS ARCHAEA Y BACTERIA Y NINGUN EUCARIOTA.
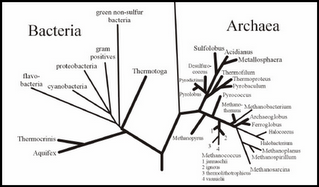
EN LA FIGURA OBSERVAMOS RESALTADOS EN NEGRITA A LAS PRINCIPALES FAMILIAS DE BACTERIAS Y ARQUEAS HIPERTERMOFILAS.
LA BACTERIA HIPERTERMOFILA MAS RESISTENTE CONOCIDA ES
Aquifex pyrophilus crece hasta a 95ºC
LA ARQUEA HIPERTERMOFILA MAS RESISTENTE CONOCIDA Y PUBLICADA ES
Pyrolobus fumarii crece hasta 113 ºC
•Max. 113ºC
•Temperatura óptima crec. 106 ºC
•Aislado de paredes de fuentes termales submarinas (Oceano altántico)
•Incapaz de crecer a menos de 90 ºC
•Cel. 0.7 – 2.5 um diámetro
•Es quimiolitoautotrófico
•Reduce nitrato, formando amonio como prod. Final
•Puede crecer en cond. Microaerófilas con Hidrógeno como donador de electrones y trazas de O2 (0.05%)
¿DONDE VIVEN ESTOS M.O.?
LOS ENCONTRAMOS EN AMBIENTES TERRESTRES Y MARINOS
EN FUENTES HIDROTERMALES SUBMARINAS Y EN LOS GEISERES, CAMPOS SOLFATIRICOS E INCLUSO EN EL SUBSUELO EN AMBIENTES TERRESTRES
¿CÓMO HACEN ESTOS MICROORGANISMOS PARA VIVIR A TALES TEMPERATURAS?
PRIMERO QUE NADA ADAPTAN TANTO SU MAQUINARIA ENZIMÁTICA Y ESTRUCTURAL PARA PODER RESISTIR ESTAS TEMPERATURA.
EN CUANTO A SU METABOLISMO LA MAYORIA SON QUIMIOLITOTROFOS, LA MAYORIA ANAEROBICOS PERO TAMBIEN LOS HAY HETEROTROFOS Y AEROBICOS.
ESTOS M.O. HAN MODIFICADO SU MEMBRANA CELULAR, LOS LIPIDOS QUE LO CONFORMAN TIENEN MODIFICACIONES LA MAYORIA TIENEN ENLACES ETER, ANILLOS CICLOPENTANO, UNIONES COVELENTES INTERNAS, ETC.
EN CUANTO A SUS PROTEINAS SUFREN LAS SIGUIENTES MODIFICACIONES
Aumento
• Variedad de puentes salinos
• Redes de puentes de hidrógeno
• Extensión de empaquetamiento de residuos no polares
• Propensidad para formar oligomeros
• Expresión de HSPs chaperonas
Disminución
• Volumen
• Longitud de lazos superficiales
EL ADN Y EL ARN TAMBIÉN SE MODIFICAN. EL ADN SE ESTABILIZA CON LA PRESENCIA DE ALTAS CONCENTRACIONES DE SAL, POLIAMINAS Y PROTEINAS CATIÓNICAS, ADEMAS POSEEN UNA ADN GIRASA REVERSA CARACTERÍSTICA QUE LES DA UN SUPERENRROLLAMIENTO POSITIVO. EN EL ARN HAY MODIFICACIONES POST-TRANSCRIPCIONALES QUE RESTRINGEN LA FLEXIBILIDAD DEL ARN.
LOS POLINUCLEOTIDOS TAMBIÉN SUFREN MODIFICACIONES
Modificaciones post-trnascripcionales
de ARNt
• 2’-metilación grupo ribosa
• N-acetilación de citidina
• Polimetilación de guanosina
BIBLIOGRAFIA RECOMENDADA
Pakchung A. et al Envirom Chem. 2006 3, 77-93
Rothschild, L. Nature 2001 409:1092-1101
KARL O. STETTER
http://www.dlr.de/me/Institut/Abteilungen/Strahlenbiologie/pdf/astrobiologie/P2_11.pdf
Charlier D. & Droogmans L Cell Moll Life Sci 62(2005) 2974-2884.
Daniel R. & Cowan D. Cell Mol. Life Sci 57 (2000) 250-264



